会社情報

- HOME
- 会社情報
- 公表事項
公表事項
- 事業継続計画(BCP)の取組みに関する情報開示
- 公正な研究活動等に関する情報開示
- GMP査察
はじめに
事業継続計画(BCP:Business Continuity Plan)とは?
企業が地震・津波・台風・感染症などの自然災害や原子力災害、火災事故などの非常事態の発生に備えて、重要事業の存続や早期復旧を可能とするために「非常事態に備える経営戦略(計画)」のことを言います。
この事業継続計画(以下「BCP」といいます。)は、人や施設を事故や災害から守る従来の「防災計画」とは異なり、発生しうる被害を想定し、業務のリスク分析及びボトルネック分析などにより、組織の脆弱性を評価することで、事業を継続させるための具体的な対策を立案することを目的に策定されます。
1.基本方針・目的・適用範囲
1.1. 基本方針・目的
医薬品の提供を通して、人々の健康に貢献する富士化学工業は、患者様をはじめ地域の皆様、世界に対しても大きな社会的責任を担っているものと自覚しています。また、医薬品サプライチェーンの中核メーカーとしての責任も自覚しています。
予想される広域災害(地震、台風、水害)及び重大な局所災害(火災、事故、故障等)の発生後の人命を尊重し、会社がいち早く事業を再開できるよう、災害に起因する従業員の経済的不安の解消や、生活行動の早期正常化を目指すと共に、できる限りの社会貢献を行うことを目的として「事業継続計画(BCP)」を策定しています。
以下の原則に従って、事業継続マネジメントを実践することにより、緊急事態発生時においても事業を継続し、企業としての社会的責任を遂行します。
【事業継続行動計画原則】
- (1)グループ社員及びその家族等の生命・安全確保を最優先に活動する。
- (2)グローバル・サプライチェーンの中で、社会的に優先すべき製品やサービスを継続的に供給し企業としての責務を果たす。
- (3)国、自治体と連携し、各拠点の近隣住民を含め被害拡大を最小限に抑える。
1.2. 適用範囲
本計画は、富士化学工業の製品・サービスを対象とする。対象については、経済性・社会性の観点から検討を行い、より重要性の高い製品を有事に優先的な復旧を図る重要製品群とする。
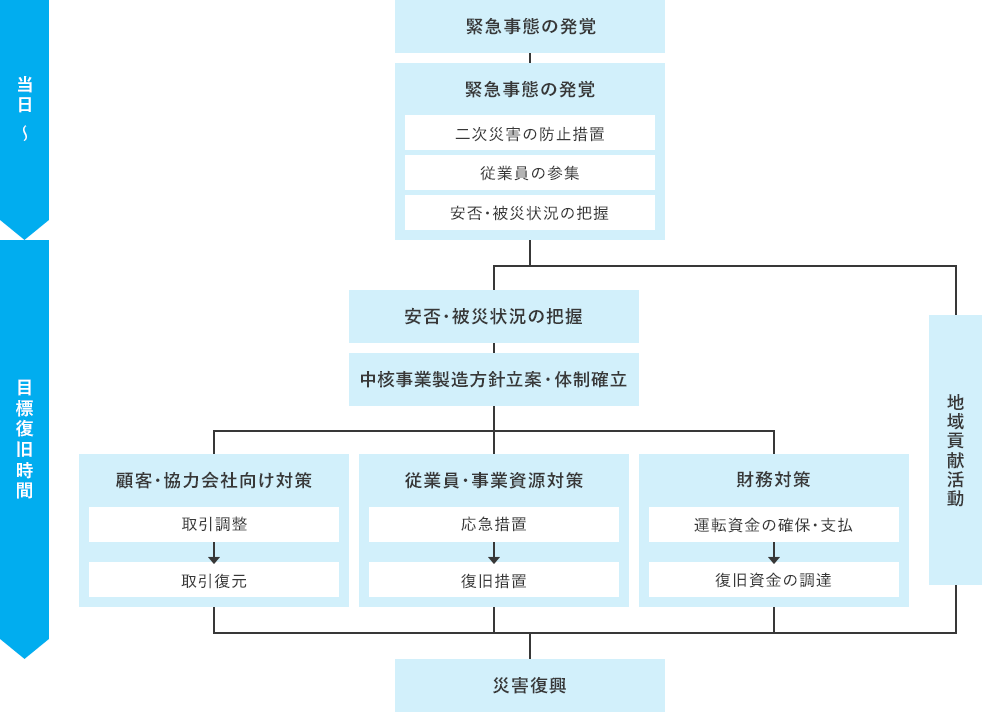
1.3. 有事の対応の全体像
有事が発生した場合、原則以下のフローに基づき行動することとする。
- (1)有事が発覚した場合、初動対応を行う。
- (2)速やかに顧客等へ被災状況を連絡するとともに、中核事業の継続方針を立案し、実施体制を確立する。
- (3)(2)に基づき、顧客・協力会社向け対策、従業員向け対策、事業資源対策、財務対策を並行して進行するとともに、地域貢献活動も実施する。
- (4)有事の収束にあわせて、平時業務への回帰を進める。
公的研究費の管理体制について
当社LS開発本部は「研究機関における公的研究費の管理・監査のガイドライン」に沿って、以下の責任体制のもと公的研究費の適正な運用・管理を行っていきます。
管理責任体制
| <総括責任者:コンプライアンス担当責任者> 研究倫理の向上及び不正行為の防止等に関し、法人全体を統括する権限と責任を有する者として、公正な研究活動を推進するために適切な措置を講じるものとする。 |
| <部局責任者:LS開発本部長> 当該部局における研究倫理の向上及び不正行為の防止等に関する責任者として、公正な研究活動を推進するための適切な措置を講じるものとする。 |
| <研究倫理教育責任者:LS研究開発部課長> 研究者等に対する研究倫理教育について実質的な責任と権限を持つ者として研究倫理教育責任者を置き、「LS研究開発部課長」を充てるものとする。 |
相談・通報の窓口
公的研究費の運用・管理及び公正な研究活動に関わる不正の疑いなどのご相談やお問合せがございましたら、下記にご連絡ください。
[ お問い合わせ ]
GMP査察
GMPに沿う高度な品質保証体制をとっています。GMPとは…
医薬品は、病気の治療や予防などの保健衛生に用いられ、人々の健康や生命に直接関与しています。 そのため、医薬品を製造する際は、定められた品質規格に適合することを確認するだけでなく、製造する過程についても適切に管理し、品質の良い優れた医薬品を恒常的に製造する必要があります。 このような医薬品を製造するための要件をまとめたものがGMP(Good Manufacturing Practice)であり、日本語では「医薬品の製造管理及び品質管理の基準」と表現されています。
- 医薬品医療機器総合機構の査察
- 2006、2011、2016、2023
- 富山県の査察
- 2000、2001、2004、2006、2009、2011、2013、2016、2017、2020、2021、2023、2025
- 海外当局の査察
- KFDA(韓国2008、2025)、EMA(欧州2012)、TMMDA(トルコ2016)、CFDI(中国2019)、ANVISA(ブラジル2019)、ロシア(2020、2023)
- FDA(米国)の査察
- -11回
1981、1983、1985、1989、1995、1999、2004、2010、(2012)、2013、2016、2018、2023
1981年から30年以上FDA対応をしています。日本国内のGMPのみならず、海外のGMPの最新ガイドラインにも注視しながら常に高いレベルでの製造管理・品質維持ができるよう努めています。日本、米国、欧州などの査察も好成績でパスしています。

 お問い合わせ
お問い合わせ